~大阪大学蛋白質研究所との共同研究成果~
データサイエンスの活用により皮膚老化に対し効果的な因子がトロンボスポンジン-1(THBS1)※1であることが判明
2024年5月9日
ロート製薬株式会社(本社:大阪市、社長:杉本雅史)は、ロートグループ経営総合ビジョン「Connect for Well-being」の実現に向け、皮膚老化に関する多角的な研究を進めています。今回、大阪大学蛋白質研究所の岡田眞里子教授、飯田渓太准教授と共に、次世代シーケンサー※2を用いた様々なオミクス解析※3と数理モデルを用いたシミュレーション解析※4を行うことで、データサイエンスを活用した新たな皮膚老化研究のターゲットを見出すことに成功しました。
本研究成果は、「iScience」オンライン(2024年4月25日付)に掲載されました。
研究成果のポイント
- 次世代シーケンスデータから老化皮膚においてトランスフォーミンググロースファクターベータ1(TGF-β1)※5シグナルが増加することを発見
- トロンボスポンジン-1(THBS1)※1とフィブロモジュリン(FMOD)※6が皮膚老化の重要な因子となることを確認
- 皮膚老化により活性化するTGF-β1がTHBS1を増加させ、FMODを減少させることを確認
- 数理モデルのシミュレーション解析により、皮膚老化のターゲットはTHBS1であることが判明
研究の背景
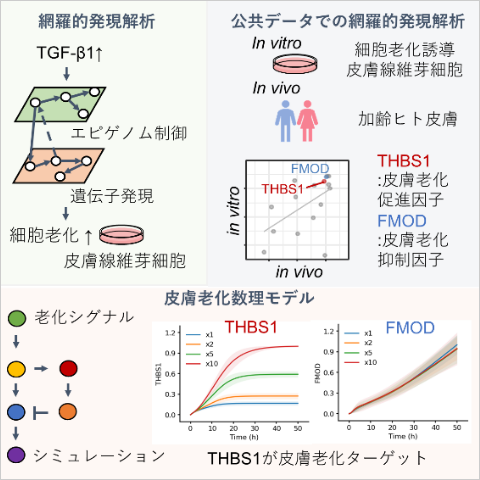
図1:本研究の概略
皮膚の老化は、紫外線などの外的要因と加齢による内的要因が複合的に関与していることが知られています。内的要因としては、加齢に伴って皮膚組織に蓄積される老化細胞が関与していることが明らかにされていますが、その発生メカニズムはまだシステムレベルで解明されていませんでした。本研究では、次世代シーケンサーを用いた様々なオミクス解析を行い、皮膚老化を誘導する上流因子を探索し、これらの実験結果に基づいた皮膚老化数理モデルの構築とシミュレーション解析を行いました(図1)。これにより、データサイエンスを活用した新たな皮膚老化因子の標的を提供し、ロート製薬の新しい研究成果を発信することを目指しました。
結果
次世代シーケンスデータから老化皮膚においてTGF-β1シグナルが増加することを発見
新生児由来正常ヒト真皮線維芽細胞を長期継代培養することにより細胞老化を誘導し、異なる細胞倍化数※7(PDL)(PDL 24, PDL 36,
PDL 47)を有する細胞を作成後、細胞を回収し、次世代シーケンサーを用いて発現解析を実施しました。細胞老化を誘導した真皮線維芽細胞のRNAシーケンス※8解析を実施した結果、サイトカイン※9の一種であるTGF-β1の下流転写因子※10であるSMAD3及びSMAD4が上昇することが見出されました(図2A)。また、細胞老化を誘導した真皮線維芽細胞のRNAシーケンス解析とATACシーケンス※11及びChIPシーケンス(H3K27Ac)※12を用いた統合解析によって、TGF-β1が主要な上流制御因子であることが同定されました(図2B)。
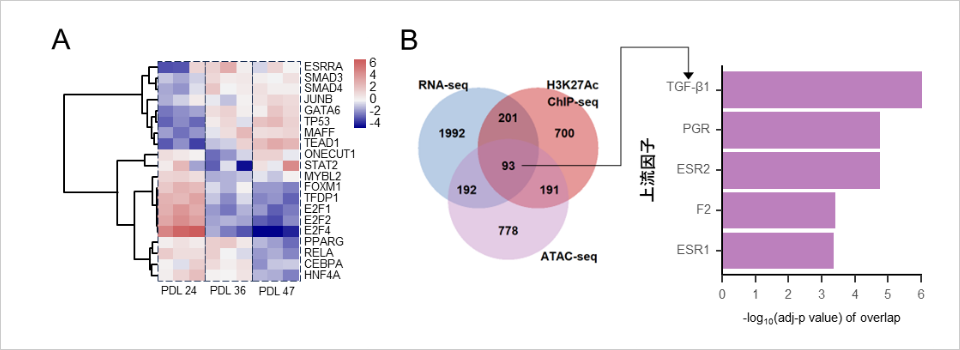
図2:皮膚線維芽細胞を用いた細胞老化誘導における次世代シーケンサーによる統合解析
<試験方法>
A. RNAシーケンスにおいてPDLの増加によって変動する遺伝子発現データを用いて、それらを制御する上位20転写因子を解析した。
B. RNAシーケンス, ChIPシーケンス(H3K27Ac), ATACシーケンスで変動する遺伝子のベン図を作成し、共通する93遺伝子を抽出し、上流因子の探索を行うためにパスウェイ解析を実施した。(大阪大学蛋白質研究所実施)
THBS1とFMODが皮膚老化の重要な因子となることを確認
続いて、2つの公共データ※13から正常ヒト真皮線維芽細胞の長期継代培養による細胞老化(in vitro)及び加齢ヒト腕由来真皮線維芽細胞(in vivo)で共通して変動している遺伝子を抽出し、遺伝子エンリッチメント解析※14を行った結果、先ほどと同じくTGF-β1経路が発現上昇することを確認しました(図3A)。また、TGF-β1経路に関連するどの遺伝子が重要なのかを調べるため、各データにおいて遺伝的発現量とPDL(in vitro)若しくは年齢(in vivo)との相関係数を計算した結果、両データによって皮膚老化においてTHBS1とFMODが高い相関性を持つ遺伝子として発見されました(図3B)。
これまでのオミクス解析の結果に関して実際の細胞老化への影響を確認するため、TGF-β1、THBS1、及びFMODを真皮線維芽細胞へ添加し、老化度指標としてβ-ガラクトシダーゼ活性を実験により評価しました。TGF-β1及びTHBS1添加条件下ではβ-ガラクトシダーゼ活性陽性細胞が増加している一方で、FMODは単独では影響を与えないものの、TGF-β1若しくはTHBS1との組み合わせでβ-ガラクトシダーゼ活性陽性細胞を減少させることが明らかになりました。従って、TGF-β1及びTHBS1は真皮線維芽細胞に対して皮膚老化促進因子として働き、FMODは皮膚老化抑制因子として働くことがわかりました(図3C)。
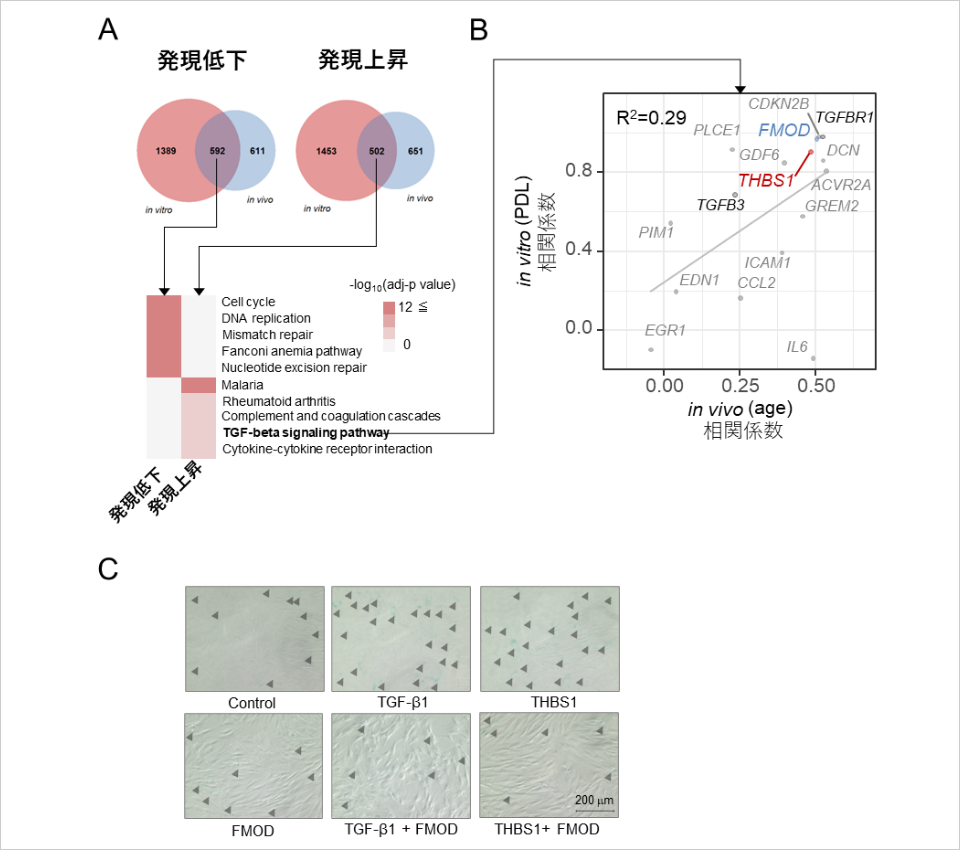
図3:公共RNAシーケンスデータを用いた皮膚老化標的遺伝子の探索及びその機能
<試験方法>
A. in vitro公共データとin vivo公共データでPDLの増加若しくは加齢によって共通して減少及び上昇する遺伝子を抽出し、Kyoto
Encyclopedia of Genes and Genomes(KEGG)データベースを用いた遺伝子エンリッチメント解析を実施した。
B. in vitro公共データとin vivo公共データで共通で変動し、TGF-β経路に関連する遺伝子を抽出し、各データにおいて遺伝的発現量とPDL(in vitro)若しくは年齢(in vivo)との相関係数を計算した。
C. 新生児由来正常ヒト線維芽細胞に対して、TGF-β1, THBS1, FMOD, TGFβ1とFMODの組み合わせ、若しくはTHBS1とFMODの組み合わせを添加して48時間培養の後、β-ガラクトシダーゼ活性を酵素反応法で染色、可視化した。β-ガラクトシダーゼ活性陽性細胞を黒い矢頭で示した;スケールバー:200µm。
(大阪大学蛋白質研究所実施)
皮膚老化及びそれにより活性化するTGFβ1がTHBS1を増加させ、FMODを減少させることを確認
次世代シーケンスデータより同定されたTHBS1とFMODが実際の細胞老化に伴ってどのように変化するのかを確認した結果、長期継代培養により細胞老化を誘導した新生児由来正常ヒト真皮線維芽細胞ではTHBS1は発現が上昇し、FMODは発現が減少することが明らかになりました(図4A)。次に皮膚老化によって活性化し、細胞老化を誘導することが示されたTGF-β1の処理による変化を確認した結果、継代培養誘導による細胞老化の影響と同じくTHBS1は発現が上昇し、FMODは発現が減少しました(図4B)。
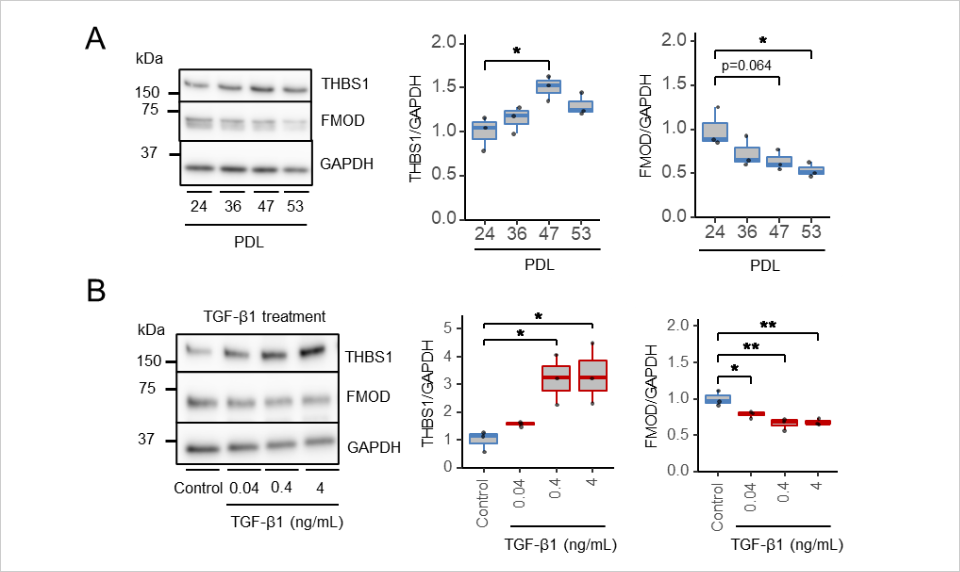
図4:長期継代培養による細胞老化若しくはTGF-β1処理による細胞老化誘導におけるTHBS1及びFMODのタンパク質発現変化
<試験方法>
A. 新生児由来正常ヒト真皮線維芽細胞を用いた継代培養による細胞老化誘導によって、異なる細胞倍化数(PDL 24, PDL 36, PDL 47, PDL 53)を有する細胞を作成。各PDLを有する細胞を培養し、48時間後の細胞溶解液中に含まれるTHBS1及びFMODのタンパク質発現変化をウエスタンブロッティング(WB)法にて確認。WBの画像は画像解析ソフトを用いて定量化した。(n=3, *p<0.05, Dunnett's test: v.s. PDL24)
B. 新生児由来正常ヒト真皮線維芽細胞に対して、TGF-β1を添加して培養し、48時間後の細胞溶解液中に含まれるTHBS1及びFMODのタンパク質発現変化をWB法にて確認。WBの画像は画像解析ソフト用いて定量化した。(n=3, *p<0.05, **p<0.01, Dunnett's test: v.s. Control)(大阪大学蛋白質研究所実施)
数理モデルのシミュレーション解析により、皮膚老化のターゲットはTHBS1であることが判明
さらに、THBS1とFMODによって制御される皮膚老化の変化を定量的に理解するために、THBS1を制御するTGF-βシグナル及びFMODを制御するVEGFシグナル伝達ネットワークを、常微分方程式を用いて記述し、測定された実験値を再現する皮膚老化数理モデルを構築しました(図5A)。次に、この皮膚老化数理モデルを用いて、皮膚老化が進行することによって引き起こされるTHBS1及びFMODのタンパク質発現変化をシミュレーションしました(図5B)。その結果、THBS1は入力依存的に変化する一方で、FMODは入力の影響をほとんど受けないことが明らかになりました。このことはTHBS1が外部からの介入でFMODに比べて制御されやすいことを示しています。
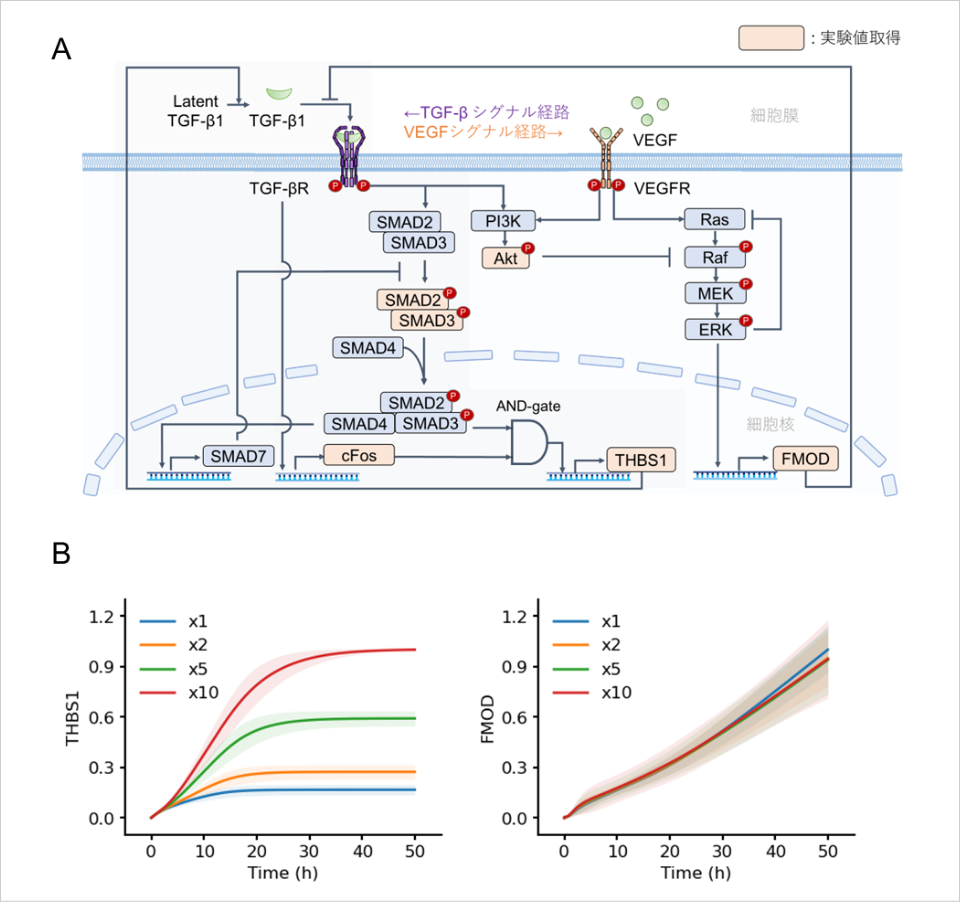
図5:数理モデルによる皮膚老化シミュレーション
<試験方法>
A. 常微分方程式を用いた皮膚老化数理モデル概略。本数理モデルはTHBS1を制御するTGF-βシグナルおよびFMODを制御するVEGFシグナル伝達経路によって構成される。
B. 皮膚老化数理モデルを用いて新生児由来正常ヒト真皮線維芽細胞に対して、時系列タンパク質発現変化をシミュレーションした。THBS1ではTGF-β1の初期値を、FMODではVEGFの初期値を、カラーコードで示すように増加させた(1倍から10倍まで)。実線は30個のパラメータセットの平均シミュレーションを示し、陰影部分は標準偏差を示す。(大阪大学蛋白質研究所実施)
考察
この度発見された皮膚老化の作用機序としては、皮膚老化の上流因子としてTGF-β1が同定され、皮膚老化と共に老化促進因子THBS1が増加する一方で、老化抑制因子FMODは減少することが明らかになりました。数理モデルを用いたシミュレーションによってTHBS1がFMODより制御されやすい因子であることが判明したほか、THBS1が皮膚老化標的であることを示唆する結果が得られました。今後は、THBS1に対する制御に関してより詳細な検討を進めていく予定です。
本研究成果が社会に与える影響(本研究成果の意義)
当社は、化粧品(薬用化粧品を含む)の製品開発において動物実験を行わないポリシーの下、ヒト細胞試験やヒトを用いる試験を活用した製品研究開発を進めております。本研究は老化、加齢研究において動物実験を用いることなく、皮膚老化システム解明において、データ主導型のオミクス解析及び数理モデルによるコンピュータシミュレーションの有効性を示しました。実世界の代表的な疾患や疾病に対するシミュレーションに対する需要は高まっており、その点で本研究は、皮膚老化に留まらない領域においても、これまで未解決な部分に対する新知見を提供していくことで、悩みを持ち続けていたお客様に新たな価値が届くことを期待しています。
特記事項
本研究成果は、2024年4月25日(木)(米国東部時間)に「iScience」オンラインに掲載されました。2024年5月17日(金)に誌面へ掲載予定です。
タイトル:Positive and negative feedback regulation of the TGF-β1 explains two equilibrium states in skin aging.
著者名:Masatoshi Haga1,2, Keita Iida1, Mariko Okada1,3
1 Institute for Protein Research, Osaka University, Suita, Osaka 565-0871, Japan
2 Basic Research Development Division, ROHTO Pharmaceutical Co., Ltd., Osaka 544-8666, Japan
3 Premium Research Institute for Human Metaverse Medicine (WPI-PRIMe), Osaka University, Suita, Osaka 565-0871, Japan
用語説明
※1:トロンボスポンジン-1(THBS1)
細胞外マトリックスに存在するタンパク質であり、細胞増殖を制御するサイトカインの1つであるTGF-β1の活性化を担います。TGF-β1は活性をもたない潜在型として産生され、活性化を受けてその作用を発揮することができます。
※2:次世代シーケンサー
従来のシーケンス法と比べて大規模かつ高速にDNAやRNAの配列情報を読み取ることが可能な装置を指します。
※3:オミクス解析
次世代シーケンサーから得られる大量の遺伝配列情報データを解析することを指します。遺伝子の解析や疾患の研究などに利用されます。
※4:シミュレーション解析
細胞内の遺伝子間の相互作用や活性を数理モデルで記述し、コンピュータ上で再現する手法を指します。細胞内シグナルの制御機構の理解や創薬研究にも活用されています。本研究では、刺激前の初期状態の遺伝子発現量や相互作用を含む情報を入力として受け取り、入力に応じた遺伝子やタンパク質発現量を出力することが可能になります。
※5:TGF-β1(トランスフォーミンググロースファクターベータ1)
細胞の成長や分化、細胞間相互作用に関与するサイトカインであり、免疫応答、炎症、組織再生、細胞の増殖、分化などの幅広い生理的プロセスを制御します。活性化されたTGF-β1は、細胞表面の受容体に結合し、シグナル伝達を介して下流転写因子であるSMAD2/3を活性化(リン酸化)することで様々遺伝子発現を制御することが知られています。
※6:フィブロモジュリン(FMOD)
細胞外マトリックスに存在するタンパク質であり、コラーゲンの線維形成と架橋に影響することが報告されています。FMODはTGF-β1と結合することにより、TGF-βシグナルの活性化を阻害することが報告されています。
※7:細胞倍化数(Population doubling level, PDL)
細胞が増殖し分裂して新しい細胞が作られる過程で、細胞数がどれだけ増えたかを示す指標です。
※8:RNAシーケンス
RNAシーケンスとは、特定の細胞や組織でどの遺伝子がどの程度活発に働いているか(遺伝子発現)を調べるための手法です。これはRNAの配列情報を読み取ることで、活性化している遺伝子の特定や量を測定します。
※9:サイトカイン
細胞から分泌され胞間の相互作用を調節し、情報伝達を媒介する生理活性タンパク質です。体内において標的細胞に受容体を介してシグナルを伝達し、細胞の増殖・分化、免疫応答や炎症反応の制御を担う重要な役割を担います。
※10:転写因子
遺伝子の転写(DNAがRNAに変換される過程)を制御するためのタンパク質です。特定の遺伝子上の特定の位置に結合し、遺伝子の発現を精密に制御します。
※11:ATACシーケンス
ATAC(Assay for Transposase-Accessible Chromatin)シーケンスは、クロマチン(DNAと結合しているタンパク質)がどの部分が開口しているか、つまり遺伝子が活性化しやすい状態になっているかを調べる手法です。これにより、特定の細胞でどの遺伝子が働きやすいかを解析することが可能です。
※12:ChIPシーケンス(H3K27Ac)
ChIP(Chromatin Immunoprecipitation)シークエンスでは、標的タンパク質に特異的な抗体を使用してクロマチン中のターゲット領域を免疫沈降します。免疫沈降されたDNA断片は、抗体と結合しているターゲット領域の情報を含んでいます。その後、免疫沈降されたDNA断片は、次世代シークエンシング技術を使用して配列解析されます。今回標的タンパク質として用いたH3K27Acは、ヒストンタンパク質H3の特定の位置でのアセチル化状態を指します。H3K27Acは活性化しているDNA領域を示すヒストン修飾マーカーとして知られています。この手法を使用することで、特定の遺伝子や領域が活性化されているのかを理解することができます。
※13:公共データ
生命科学研究では、培養細胞、モデル動物、ヒト疾患における遺伝子やタンパク質の網羅的計測値は、データベースに保存されており、公共利用が可能です。例えば遺伝子の網羅的測定データとしては米国国立バイオテクノロジーセンターのGEO(Gene
Expression Omnibus)が知られており、遺伝子発現データや関連する実験データが保存されています。GEOデータベースは、研究者が遺伝子発現パターンや関連する実験データを共有し、それを他の研究者が再利用できるようにするために構築されています。今回はin vitro公共データとして新生児由来正常ヒト真皮線維芽細胞を長期継代培養することにより細胞老化を誘導し、異なる細胞倍化数(PDL 16, PDL 26,
PDL 46, PDL 64, PDL 74)を有するRNAシークエンスデータ(アクセション番号: GSE63577)を利用しました。またin vivo公共データとして、1歳から94歳までの133人のヒト皮膚線維芽細胞のRNAシークエンスデータ(アクセション番号: GSE113957)を利用しました。
※14:遺伝子エンリッチメント解析
遺伝子発現データをデータベースと比較して、遺伝子シグナル経路を解析する手法です。この解析手法により、特定の研究テーマに関連する遺伝子や化合物を特定し、それらの機能や相互作用を理解することができます。また、KEGG(Kyoto
Encyclopedia of Genes and Genomes)のデータベースは、疾患のメカニズムの解明や新たな治療法の開発など、生物医学研究にも広く活用されています。